Winzige Boote, die sich durch den Blutstrom fortbewegen, beladen mit Arzneimitteln, so klein, dass sie mit dem bloßen Auge nicht zu erkennen sind. Das klingt zunächst nach Science-Fiction, basiert aber auf der Strategie, Wirkstoffe per Mikroroboter gezielt an ihren Wirkort zu bringen. Welche Baupläne und Ideen stecken in den Köpfen der Ingenieure
und wie weit fortgeschritten sind die Anwendungen bereits?
Lange nicht alle Arzneimittel setzen sich an dem Ort im Körper ab, an dem die Krankheit lokalisiert ist, gegen die sie eingesetzt werden. Die Folgen sind oft unerwünschte Arzneimittelwirkungen. 30% der Wirkstoffe, die sich in der Pipeline befinden, schaffen es aufgrund unkontrollierbarer Toxizität nicht in die klinische Phase. Sogenannte Mikroroboter sollen das ändern,
indem sie ein Arzneimittel zum Ursprung einer Krankheit transportieren. Dort sollen sie die Wirkstoffe
gezielt freisetzen, z. B. bei einem Thrombus oder einem Tumor. Gelingt das, könnten auch Arzneimittel, die
als „zu“ toxisch gelten, den Weg in klinische Studien schaffen. Schwer zugängliche Stellen im Körper könnten dann adressiert werden, um z. B. Arzneistoffe ins Gehirn zu befördern [1].
Mikroorganismen als Vorbild
Einige Mikroroboter werden nach dem Vorbild von beweglichen Mikroorganismen entwickelt, denn deren Fortbewegungsstrategien sind an kleine Maßstäbe angepasst und sehr dynamisch. Ohne Antrieb würden so kleine Strukturen wie Bakterien nicht von der Stelle kommen. So bewegen sie sich mittels rotierender Geißeln fort, der Parasit Trypanosoma brucei ist sogar in der Lage, seine Morphologie an seine Umgebung anzupassen, um sich optimal fortzubewegen. Er nimmt eine lange schlanke Form mit einer Geißel an, wenn er durch Körperflüssigkeiten vorantreibt. Sogenannte Wimperntierchen sind von zahllosen Härchen übersät, die sie zeitlich aufeinander abgestimmt bewegen [1, 2].
Fortschritte in der Materialwissenschaft ermöglichen es, die komplexen Antriebsmechanismen der Mikroorganismen umzusetzen. Dabei werden weiche Komponenten wie beispielsweise Polymere, aber auch Membranen, Kolloide, Gele, Schäume oder Proteine verwendet. Das verleiht den Mikrorobotern vielfältige Eigenschaften, man spricht von sogenannten intelligenten Materialien. Es wurden bereits Mikroorganismen und kontraktile Säugetierzellen als Mikroantrieb eingesetzt und in funktionelle synthetische Materialien integriert. Dazu werden beispielsweise Geißelbakterien oder kontraktile Säugetierzellen wie Herzmuskeln
verwendet, die chemische Energie in mechanische umwandeln können [1, 3].
Wie gelangt der Mikroroboter zum Ziel?
Um die Mikroroboter in den menschlichen Körper zu befördern, müssen sie zunächst mit einem Katheter oder Endoskop in die entsprechende Körperregion, z. B. in der Nähe eines Tumors, implementiert werden. Zwar sind die Mikroroboter mobil, doch können sie nur kleine Strecken in realistischen Zeiten zurücklegen. Zur Veranschaulichung: Mit einer Geschwindigkeit von
100 μm/s benötigt ein Mikroroboter drei Stunden, um vom Arm zum Gehirn (circa 1 m) zu gelange. Soll er dort einen Thrombus auflösen, dauert das zu lange. Sind die Mikroroboter per Katheter ins Blutgefäßsystem eingeführt, können sie die kurze Strecke bis zum Ziel navigieren. Dort angekommen, zerlegen sie sich und setzen die Wirkstoff-Moleküle frei (s. Abb.). Im Anschluss werden die Strukturen vom Körper resorbiert oder ausgeschieden. Zum Beispiel wurden bereits Mikroroboter aus Polymeren entwickelt, die sich durch pH-Wert-Änderungen oder enzymatische Verdauung abbauen lassen.
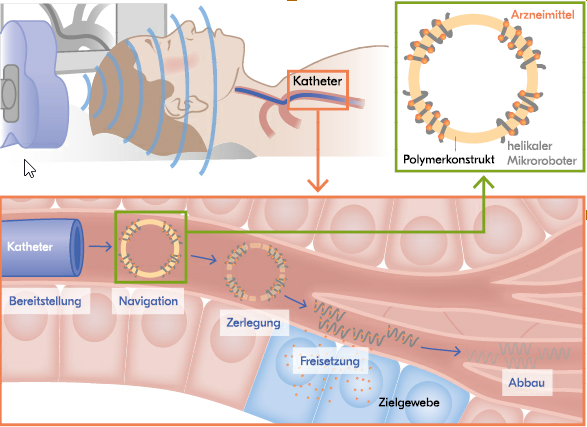
(Grafik: DAZ/Hammelehle)
Ein zentrales Problem ist die Frage, wie die Mikroroboter vom Katheter oder Endoskop bis zum Ziel navigiert werden können. Für den Antrieb gibt es dabei verschiedene Strategien. So können die Roboter Treibstoff aus den sie umgebenden Medien gewinnen oder aus externen Energiequellen wie Licht oder Ultraschall. Letztendlich ist Magnetismus eine geeignete Option, um die Strukturen durch Gewebe und Flüssigkeiten zu bewegen. Als magnetisches Material für die Mikroroboter eignet sich dabei Eisen, denn im Vergleich zu anderen Materialien wie Nickel oder Kobalt hat Eisen sowohl geeignete magnetische Merkmale als auch eine gute Biokompatibilität. Um die magnetischen Mikroroboter schließlich zu navigieren, muss ein magnetisches Navigationssystem in der Nähe des Patienten positioniert werden. In Betracht kommen Dauermagneten, welche allerdings nicht abgestellt werden und deshalb auch eine Gefahr sein können, z. B. wenn sie in Kliniken Kräfte auf medizinische Geräte ausüben. Erste Tierversuche mit den magnetischen Mikrorobotern wurden in der diagnostischen zerebralen Angiografie bereits durchgeführt [1].
| Science-Fiction wird Wirklichkeit Im Science-Fiction-Film „Die phantastische Reise“ von 1966 lässt sich ein Team aus Medizinern samt U-Boot so stark verkleinern, dass sie in den Körper eines Menschen eingebracht werden können. Ihre Mission: Ein tödliches Blutgerinnsel aus dem Gehirn des Patienten zu entfernen, das auf andere Weise nicht aufgelöst werden kann. Die Besatzung erlebt eine fantastische Reise durch das Innere des Menschen, allerdings kommt es zu gefährlichen Situationen, weil der Einsatz sabotiert wird. Mikroroboter sollen sich ebenfalls eines Tages durch Gewebe, Schleimhäute, die Blut-Hirn-Schanke oder das Auge im menschlichen Körper bewegen. Anstatt eines Teams aus verkleinerten Medizinern sollen die Roboter dann Wirkstoffe „dabei haben“. |
Tracking der Roboter
Während ihrer Reise durch die Blutgefäße muss auch nachvollzogen werden können, an welchem Ort sich die Mikroroboter befinden. Die Auflösung eines einzelnen Roboters ist mit Verfahren wie der Computertomografie oder Magnetresonanztomografie im Organismus schwierig. Allerdings sollen die Roboter in Schwärmen oder übergeordneten Strukturen appliziert werden, um die therapeutische Aufgabe zu erfüllen. In der Mehrzahl funktioniert ihre Lokalisation mit den genannten gängigen Bildgebungsverfahren [1].
Beispiele für Mikroroboter
Auch Wissenschaftler der Abteilung Intelligente Systeme des Max-Planck-Instituts in Stuttgart entwickeln Mikroroboter. Beispielsweise nahmen sie sich die Jakobsmuschel zum Vorbild, um einen magnetischen Mikroschwimmer zu bilden. Dessen Hälften sind durch ein Gelenk verbunden und ein Magnetfeld kann die „Schalen“ bewegen, sodass die Mikromuschel in biologischen Flüssigkeiten vorankommt. Auch entwickelten sie einen Korkenzieher-ähnlichen Mikroroboter aus einem Hydrogel per 3-D-Druck. Seine Schwimmrichtung kann ebenfalls durch ein Magnetfeld beeinflusst werden. Das Hydrogel löst sich mit der Zeit auf. So kann ein Arzneimittel direkt an einem Tumor appliziert werden. Zusätzlich enthält der Roboter ein Kontrastmittel, das von den Krebszellen aufgesaugt wird, um diese sichtbar zu machen. Damit der Mikroroboter spezifisch an Krebszellen andockt, wurde er mit Antikörpern gegen Matrix-Metalloproteinasen ausgestattet. Diese Enzyme kommen in Krebszellen vor und lösen die Arzneimittelfreigabe aus [4, 5].
Bis Mikroroboter es vom Labor in die Klinik schaffen, muss noch an vielen Stellen weitergeforscht werden, doch kommt man der „Science-Fiction“ näher. Sie könnte helfen, die gezielte Arzneimitteltherapie zu verbessern.
Literatur
[1] Nelson BJ, Pané S. Delivering drugs with microrobots:
Biomedical microrobots could overcome current challenges in targeted therapies. Science 2023, 392:1120-1122
[2] Huang H et al. Soft micromachines with programmable motility and morphology. Nature Communications 2016:7:12263
[3] Hu C et al. Soft Micro- and Nanorobotics. Annual Review of Control, Robotics, and Autonomous Systems 2018;1:53-75
[4] Intelligente Mikroroboter: Eine Revolution im Bereich der minimalinvasiven Medizin bahnt sich an. Information des Max-Planck-Instituts, Stand: 2017, https://www.mpg.de/11862963/mpi-mf_jb_2017
[5] Hübner K. Mikroroboter kommen in Fahrt. Information des Max-Planck-Instituts, https://www.mpg.de/10808196/W003_Material_Technik_054-061.pdf
